

Clinical Trials คือ การวิจัยแบบทดลอง เพื่อเปรียบเทียบคุณค่าของกระบวนการป้องกันโรคหรือ วิธีการรักษาใหม่ กับวิธีการป้องกันและการรักษา ที่ใช้เป็นมาตรฐานอยู่ในปัจจุบัน วิธีการป้องกันหรอืรักษาโรค อาจจะเป็นการฉีดวัคซีน ให้สุขศึกษา ให้ยา หรือการผ่าตัด เป็นต้น การวิจัยแบบ Clinical Trials มักจะต้องมีการจำแนกผู้ป่วยหรือประชากรออกเป็นกลุ่ม ๆ อย่างน้อยสองกลุ่ม คือ กลุ่มทดลอง (วิธีการใหม่) และกลุ่มควบคุม (วิธีการเดิม) ยกเว้นในขั้นตอนแรก ๆ ของการวิจัย
|
ก่อนเริ่มการวิจัยในมนุษย์ จะต้องมีข้อมูลเกี่ยวกับการศึกษาในสัตว์ทดลองมากพอ และเป็นที่พอใจเสียก่อน ที่จะกล่าวต่อไป จะเน้นถึงขั้นตอนการวิจัยเฉพาะในมนุษย์ หลังจากที่หลักฐานในสัตว์ทดลองเป็นที่น่าพอใจแล้ว จะกล่าวถึง Clinical Trials ทีเกี่ยวกับการใช้ยาหรือสารเคมีเป็นส่วนใหญ่
ขั้นตอนที่ 1 (Phase I)
คือการทดลองสารเคมีชนิดใหม่ที่ยังไม่เคยมีการใช้ในนุษย์มาก่อน เพื่อทราบว่าการนำมาใช้จะปลอดภัยหรือไม่ การศึกษาทำในอาสาสมัครปกติ เพื่อดูเภสัชวิทยาในคน ว่าเหมือนในสัตว์ทดลองหรือไม่ ควรทำในโรงพยาลาลที่เตรียมการรักษาภาวะแทรกซ้อนไว้เป็นอย่างดี ห้ามทดลองในเด็ก ผู้สูงอายุ สตรีวัยเจริญพันธ์ ผู้ป่วยอาการหนัก ยาที่ทดลอง จะต้องไม่เป็นยาที่ใช้รักษามะเร็ง เพราะยาเหล่านี้มักมีพิษสูง จำนวนอาสาสมีครที่ใช้มีไม่มาก ไม่ควรมีเกิน 10 ราย และทุกรายต้องเขียนคำยินยอมให้ทดลองยาเป็นลายลักษณ์อักษร
Clinical Trials ขั้นตอนที่หนึ่งยังแบ่งได้เป็นสองขั้นตอนย่อย ในขั้นแรก เป็นการศึกษาเปิด ทั้งอาสาสมัครและผู้วิจัย ทราบว่ากำลังทดลองยาอะไร ในขั้นนี้ไม่มีกลุ่มควบคุม (control) ต้องให้ยาขนาดน้อยมาก คือ 1/50 - 1/100 ของขนาดยาที่ใช้ได้ผลในสัตว์ทดลอง โดยใช้ยาเพียงขนาดเดียวก่อน มีการศึกษาการเปลี่ยนแปลงของสภาพร่างกาย และการทำงานของอวัยวะต่าง ๆ ทั้งก่อนและหลังให้ยาเป็นระยะ ๆ ต่อเมื่อได้ผลเป็นที่น่าพอใจแล้ว จึงเริ่มทดลองขั้นตอนต่อไป โดยอาจจะเพิ่มขนาดยา
ขั้นตอนที่ 2 (Phase II)
เป็นการนำยาหรือสารเคมีที่ผ่านการทดสอบขั้นตอนที่ 1 แล้ว มาทดลองใช้ในผู้ป่วยที่เป็นเป้าหมายของการรักษาพยาบาล (ไม่ใช่คนปกติ) และเก็บข้อมูลเกี่ยวกับฤทธิ์และพิษของยาที่พบบ่อย รวมทั้งรายละเอียดต่าง ๆ ทางเภสัชวิทยาโดยละเอียด ในขั้นตอนนี้สามารถศึกษายาสลบ และยารักษาโรคมะเร็งในคนได้ โดยต้องทำเป็นการศึกษาเปิด คือ ทั้งผู้ป่วยและผู้วิจัย ทราบว่ายาที่ได้รับเป็นยาทดลอง
จำนวนผู้ป่วยอาจใช้ได้ 20 - 30 ราย อาจจะพบภาวะแทรกซ้อนที่เกิดขึ้นง่าย หรือพบฤทธิ์ยาที่ไม่เคยคาดคิดมาก่อน ถ้าพบภาวะแทรกซ้อนรุนแรงอยู่เสมอ ก็สมควรจะหยุดการศึกษาในขั้นตอนนี้
ขั้นตอนที่ 3 (Phase III)
ในขั้นตอนนี้ สามารถศึกษาผู้ป่วยเพิ่มขึ้นได้ จำนวนที่ใช้ประมาณ 200 - 300 ราย ต้องเพิ่มกลุ่มควบคุมที่ไม่ได้รับยา เข้าไปเปรียบเทียบกลุ่มที่ได้รับยา โดยที่ทำให้กลุ่มทดลองและกลุ่มควบคุม เหมือนกันทุกประการ ต่างกันเพียงเรื่องว่าได้รับยาหรือไม่ การทำให้กลุ่มทดลองและกลุ่มควบคุมเหมือนกัน จำเป็นต้องอาศัยระเบียบวิธีการวิจัย ซึ่งจะเน้นในบทความนี้ คือต้องมีการควบคุมทั้งในขั้นตอนการคัดเลือก การแบ่งกลุ่มการให้การรักษา การติดตามผล และการประเมินผล ถ้าเป็นได้เป็นการศึกษาทั้งที่ผู้ป่วยและผู้วิจัย ไม่ทราบว่าผู้ป่วยได้ยาอะไร (double blind) ยาที่ผ่านการศึกษา ขั้นตอนนี้แล้วจะออกสู่ท้องตลาดได้
ขั้นตอนที่ 4 (Phase IV)
เป็นขั้นตอนที่ศึกษาหลังจากยาตำรับนั้น ได้รับการจดทะเบียนแล้ว มีจุดมุ่งหมายเพื่อศึกษาผลการรักษา ภาวะแทรกซ้อน และพิษของยา ในผู้ป่วยที่มีจำนวนมากขึ้น และใช้ยาเป็นเวลานานขึ้น เพื่อให้แน่ใจว่าผลสรุปที่ได้จากการทดลองขั้นตอนที่สามนั้นถูกต้อง มักจะต้องมีการติดตามผู้ป่วยเป็นพันขึ้นไป
ขั้นตอนที่ 5 (Phase V)
เป็นขั้นตอนหลังจากยาออกสู่ตลาด และมีการใช้กันอย่างกว้างขวาง เป็นการเฝ้าระวังภาวะแทรกซ้อนในผู้ป่วยเป็นหมื่น เป็นแสนคน
ในขั้นตอนที่หนึ่งและสองของ clinical trials อาจจะไม่ใช้แพทย์ทำ �ไแต่ใช้นักเภสัชวิทยาคลินิก (clinical pharmacologist) เป็นผู้ทำแทน นักเภสัชวิทยาคลินิก เป็นนักวิทยาศาสตร์ สาขาวิทยาศาสตร์การแพทย์ ที่ได้รับการฝึกฝนมาเฉพาะ ในการทำวิจัย นักเภสัชวิทยาคลินิกต้องอยู่ภายใต้การควบคุมของแพทย์ เป็นการลดภาระงานของแพทย์ และเชื่อมโยงระหว่างเภสัชวิทยาพื้นฐาน และ เภสัชวิทยาคลินิก
|
ต่อไปนี้จะได้กล่าวถึงแนวทางในการวางแผนทำ Clinical Trial โดยเฉพาะ Phase III แนวทางที่จะกล่าวนี้เป็นแนวทางสั้น ๆ ส่วนรายละเอียดในบางส่วนที่สำคัญ จะได้กล่าวไว้ในหัวข้อ 3
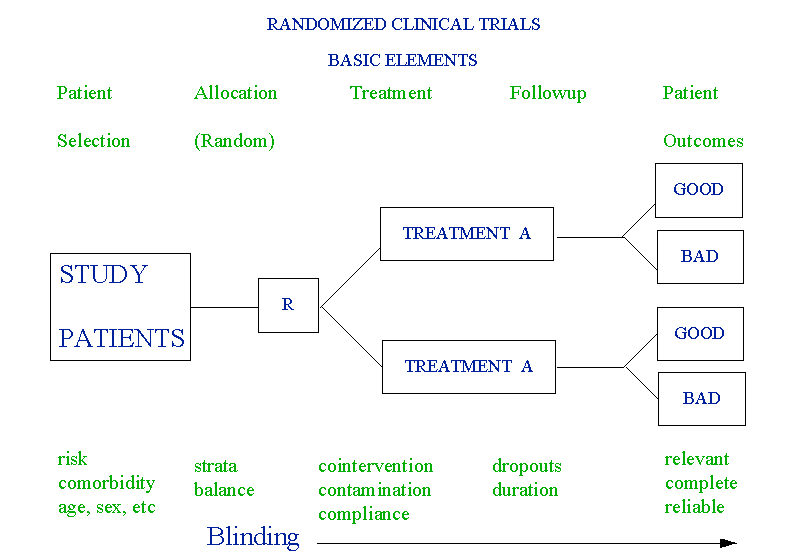
2.1 การรวบรวมความรู้พื้นฐานและความรู้ที่เกี่ยวข้องกับหัวข้อที่จะทำการวิจัย
ก่อนที่จะทำ Clinical Trial ใน phase III จำเป็นต้องทบทวนความรู้และผลงานวิจัยที่เคยมีผู้ทำมาแล้วในสัตว์ทดลองใน Phase I และ Phase II ตลอดจนการวิจัยใน Phase III จากหนังสือและวารสารต่าง ๆ ว่าได้มีผู้กระทำมาแล้วหรือไม่ มากน้อยเพียงใด ผลงานวิจัยที่ออกมาเชื่อถือได้ตามหลักของ Methodology หรือไม่ โดยอาศัยแนวทางการอ่านผลงานวิจัยเกี่ยวกับ Therapy ในขั้นตอนนี้ ถ้าพบว่าไม่มีการวิจัยใน Phase นี้ หรือถึงแม้ว่าจมีแล้วแต่ผลงานยังเชื้อถือไม่ได้ก็สมควรที่จะคิดวางแผนการทำวิจัยในหัวข้อนั้น ๆ ต่อไป
2.2 การตั้งวัตถุประสงค์ของการวิจัย
ก่อนที่จะทำกาวิจัย จำต้องกำหนดวัตถุประสงค์ของการวิจัยให้แน่นอนว่า ต้องการศึกษายาอะไร ในคนกลุ่มใด และต้องดูผลอะไรของยานั้น การตั้งวัตถุประสงค์อาจจำแนกเป็น
2.2.1 Primary question เป็นวัตถุประสงค์ หรือคำถาม ที่จะต้องการทราบเป็นหลักในการวิจัย เรื่องหนึ่ง จะมีคำถามหลักได้เพียง หนึ่งหรือสองคำถามเท่านั้น เพราะการคำนวณขนาดของตัวอย่างประชากรที่ศึกษา ต้องคำนวนตามวัตถุประสงค์ของคำถามหลัก การตั้งวัตถุประสงค์หลักนี้ จะต้องตั้งอย่างรัดกุม เช่น "การศึกษาผลของการฉีด human tetanus imunoglobulin เข้าน้ำไขสันหลัง เพื่อรักษาผู้ป่วยผู้ใหญ่ที่เป็นบาดทะยัก เปรียบเทียบกับผู้ป่วยที่ได้รับ standard immunoglebulin โดยดูการเปลี่ยนแปลงในเรื่องอัตราตาย ในผู้ป่วยทั้งสองกลุ่ม
2.2.2 Seconday question เป็นวัตถุประสงค์ หรือคำถาม ที่ต้องการทราบรองลงมา โดยทั่วไปในการวิจัยหนึ่ง ผู้วิจัยต้องการคำตอบ มากกว่าหนึ่งคำตอบ เพื่อความคุ้มค่าในการลงทุนทำการวิจัย คำตอบอื่น ๆ ที่ต้องการทราบ นอกเหนือจากวัตถุประสงค์หลัก หรือคำถามหลัก จะจัดอยู่ในวัตถุประสงค์รอง หรือคำถามรอง จำนวนประชากรที่จะทำการวิจัย มิได้คำนวณจากคำถามรอง คำตอบหรือผลงานวิจัยจากคำถามรอง อาจจะพบว่าไม่มีความสำคัญทางสถิติ โดยที่ความจริงแล้ว อาจมีความสำคัญก็ได้ เนื่องจากขนาดของประชากร อาจไม่เพียงพอ ในการตอบคำถามนั้น ๆ แม้ว่าวัตถุประสงค์รอง จะมีความสำคัญน้อยกว่าวัตถุประสงค์หลัก แต่ผลงาน หรือคำตอบที่ออกมา ก็จะเป็นแนวโน้มที่จะทำการศึกษาวิจัยในอนาคต ตัวอย่างวัตถุประสงค์รอง หรือคำถามรอง เช่น "การฉีด human tetanus immunoglebulin สามารถจะลดอัตราการเกิด ภาวะแทรกซ้อนทางปอด หัวใจ ในผู้ป่วยที่เป็นบาดทะยัก เมื่อเปรียบเทียบกับผู้ป่วยที่ได้รับ Standard immunoglobulin หรือไม่ จะเห็นได้ว่า ในทั้งคำถามหลัก และคำถามรอง จะประกอบด้วย ประชากร (ผู้ใหญ่ที่เป็นบาดทะยัก) วิธีการรักษา (การฉีด human tetanusimmunoglebulin หรือ standard immunoglebulin) การวัดผลการรักษา (อัตราตาย อัตราเกิดภาวะแทรกซ้อน)
2.3 การเลือก Researc design
หลังจากที่ได้กำหนดวัตถุประสงค์ หรือคำถามแล้ว ก็ถึงขั้นตอนที่จะเลือกแบบแผนการวิจัย (Research design) ใน clinical trial แบบแผนการวิจัยจำเป็นต้องมีกลุ่มควบคุม เพื่อเปรียบเทียบกับกลุ่มที่จะศึกษา ซึ่งกลุ่มควบคุมนี้ อาจเป็นชากรอีกกลุ่มหนึ่ง ในกรณีที่เป็นโรคเฉียบพลัน เช่น ในกรณีของบาดทะยัก หรือาจเป็นประชากรกลุ่มเดียวกัน (cross-over design) ในกรณีเป็นโรคเรื้อรัง และไม่มีการเปลี่ยนแปลงในธรรมชาติของโรค ในระยะเวลาอันสั้น เช่น ในกรณีของโรคลมชัก ไมเกรน การที่จะให้ประชากรกลุ่มควบคุม หรือกลุ่มที่ศึกษา ได้รับการรักษาใด ก็มักจะทำแบบ Randomization เพื่อหลีกเลี่ยงอคติ ที่เกิดจากการแบ่งกลุ่ม ส่วนการทำ blind ซึ่งจะเป็น single หรือ double blind นั้น ก็ขึ้นกับลักษณะของวัดผล ถ้าการวัดผลจุดใดอาจมีอคติ ก็จะต้องทำ blind ในจุดนั้น ๆ ตัวอย่าง Research design ที่นิยมใช้กันเสมอ ได้แก่ Randomized controlled trial, Double blind randomized controlled trial, cross-over
2.4 การเลือกประชากรที่จะศึกษา
การเลือกประชากรที่จะศึกษา หรือตัวอย่าง หรือประชากรเป้าหมาย จะต้องสอดคล้องกับคำถามที่ตั้งขึ้น ในการเลือก ต้องกำหนดเกณฑ์ให้ประชากรที่จะศึกษามีลักษณะคล้ายคลึงกัน เพื่อสามารถเปรียบเทียบกันได้ และเพื่อลดอคติที่อาจเกิดขึ้นได้ นอกจากนี้ ขนาดตัวอย่างที่นำมาศึกษา ต้องเพียงพอด้วย แนวทางการเลือกตัวอย่างมีดังนี้
2.4.1 Inclusion Criteria เป็นเกณฑ์ที่จะเลือกผู้ป่วยมาศึกษา (ดูรายละเอียดในข้อ 3.1)
2.4.2 Exculsion Criteria เป็นเกณฑ์ที่ตัดผู้ป่วยออกจากการศึกษา (ดูรายละเอียดในข้อ 3.1)
2.4.3 Sample Size ขนาดของประชากรที่จะศึกษากำหนดขึ้นโดยอาศัยข้อมูลต่อไปนี้
1. อัตราการตอบสนองต่อการรักษาในกลุ่มควบคุม (การรักษาเดิม) ซึ่งได้จากการทบทวนเอกสาร ที่เคยมีผู้ทำวิจัยไว้แล้ว หรือได้จากประสบการณ์ของผูที่จะทำการวิจัย ในกรณีที่ไม่เคยมีผู้ทำมาก่อน เช่น บาดทะยักในผู้ใหญ่ที่ทำการรักษาแบบเดิม มีอัตราตาย 30%
2. อัตราการตอบสนองในกลุ่มที่จะได้รับการรักษาใหม่ (กลุ่มศึกษา) กำหนดขึ้นจากการทดลองในสัตว์ทดลองหรือใน Phase II หรือใน Phase III ที่เคยมีผู้ทำมาแล้ว แต่ยังไม่ได้ผลแน่นอน นอกจากนี้ยังไม่เคยมีการศึกษามาก่อน อาจต้องกำหนดจาก ความเป็นไปได้ของผลการรักษา และความน่าสนใจของยาใหม่ที่จะทำให้เกิดการเปลี่ยนแปลงในตัววัด เช่น การใช้ human immunoglebulin สามารถจะลดอัตราตายในผู้ป่วยบาดทะยักลงเหลือ 15% นี้ ได้จากข้อมูลที่เคยมีผู้ทำไว้บ้างแล้ว และในสัตว์ทดลอง และความน่าสนใจที่ยานี้ อาจลดอัตราตายลงครั้งงหนึ่งของอัตราเดิม ถ้ายานี้ลดอัตราตายไม่ถึงครึ่งหนึ่ง ของอัตราเดิม เช่น ลดได้เพียง 25% อาจไม่คุ้มที่จะนำมาใช้เพราะยานี้มีราคาแพง เป็นต้น
3. และ B error คือ ค่าตัวเลขที่บอกโอกาสสรุปผิดทางสถิติ ที่นักวิจัยทั่วไปยอมรับ ค่านี้มีกำหนดไว้อยู่แล้ว (ดูได้จาข้อ 2.6)
2.5 การแบ่งกลุ่มผู้ป่วย
เพื่อให้ประชากรที่จะศึกษา มีโอกาสเป็นกลุ่มควบคุมและกลุ่มศึกษา โดยเท่าเทียมกันเพื่อหลีกเลี่ยงอคติที่อาจเกิดขึ้น (ดูได้จากข้อ 3.2)
2.6 วิธีการศึกษา (Manoeuvre)
การกำหนดรายละเอียดเกี่ยวกับวิธีการศึกษามีความจำเป็นอย่างยิ่ง เพื่อให้ผู้ที่จะนำการวิจัยนั้นไปใช้ สามารถทำได้อย่างถูกต้อง มีขั้นตอน และถ้ามีผู้ต้องการศึกษาซ้ำ ก็จะสามารถทำได้ การกำหนดการศึกษานี้ จำเป็นต้องระบุว่าใคร เป็นอะไร กับใคร ด้วยวิธีการอย่างไร เมื่อใด และถ้าเป็นยา ใช้ขนาดยา และวิธีการบริหารยาอย่างไร (ดูรายละเอียดในข้อ 3.3, 3.4)
2.7 การกำหนดตัววัด
จากวัตถุประสงค์ หรือคำถามก็จะทราบว่า จะต้องการวัดอะไร บางครั้งตัววัดตรงไปตรงมา เช่น อัตราตาย แต่บางครั้งตัววัดอาจมีปัญหาได้ เช่น การลดลงของอาการปวด ในกรณีเช่นนี้ จำเป็นต้องกำหนด criteria หรือเกณฑ์ของตัววัดให้แน่นอน แนวทางการเลือกตัววัดดูได้จาข้อ 3.5
2.8 การวิเคราะห์ข้อมูล การวิเคราะห์ข้อมูลเพื่อ
2.8.1 ดูความแตกต่างในลักษณะสำคัญของประชากรในกลุ่มควบคุม และกลุ่มศึกษา ว่ามีหรือไม่ โดยเฉพาะในเรื่องของ "ตัวกวน" หรือ confounder ถ้าความแตกต่างมีมาก ผลที่ออกมาอาจไม่ใช่ผลของการรักษา แต่เป็นผลจากโรคที่เป็น โรคที่เกิดร่วมกัน หรือการรักษาอื่น ๆ ที่นอกเหนือไปจากการรักษาใหม่
2.8.2 ดูความแตกต่างทั้งในด้านความสำคัญทางคลินิก และความสำคัญทางสถิติ (ข้อ 3.6)
2.8.3 ดูความแตกต่างใน subgroup หรือกลุ่มย่อยต่าง ๆ ของประชากรว่ามีการตอบสนองต่อการรักษาต่างกันหรือไม่เพียงใด
2.9 จริยธรรม
การวางแผนการวิจัยใดก็ตาม จะต้องคำนึงถึงหลักจริยธรรมเสมอ การพิจารณาถึงเรื่องของจริยธรรมใน Clinical Trial ดูได้จากข้อ 3.7
|
3.1 ตัวอย่างหรือประชากรเป้าหมาย
จะต้องมีการกำหนดตัวอย่างหรือประชากรเป้าหมายให้ชัดเจน ตัวอย่างอาจได้มาจากผู้ป่วยในโรงพยาบาล หรือประชากรในชุมชน ทั้งสองมีหลักการคล้ายกัน แต่โดยธรรมชาติ การศึกษาในชุมชนควบคุมได้ไม่เข้มงวดนัก เพราะชุมชนเปลี่ยนแปลงเสมอ การบริหารงานวิจัยจึงกระทำได้ยากกว่า เหตุผลที่ต้องมีคำจำกัดความของตัวอย่างชัดเจนมีดังนี้
1. เพื่อสามารถสรุปผลการวิจัยได้ว่า จะนำไปใช้กับผู้ป่วยกลุ่มใดหรือประชากรกลุ่มใด
2. เพื่อให้ผู้อ่านผลวิจัยทราบว่า ยาหรือสารเคมีจะมีประโยชน์ต่อผู้ป่วยหรือประชากรชนิดใด
3. เพื่อสามารถเปรียบเทียบผลงานวิจัยที่ทำกับงานวิจัยอื่น
4. เพื่อสามารถทำวิจัยซ้ำ กับผู้ป่วยทำนองเดียวกันได้ในโอกาสต่อไป
แนวทางเลือกประชากรเป้าหมาย มีดังนี้
1. ผู้ป่วยหรือประชากร จะต้องมีโอกาสได้รับประโยชน์จากยา หรือสารเคมีที่จะศึกษา เช่น ถ้าจะทดลองผลของวัคซีน ก็ต้องทดลองในกลุ่มอายุที่ยังมีโอกาสติดโรค
2. ผู้ป่วยต้องไม่มีโรค หรือสภาพร่างกายที่ทำให้วัดผลการศึกษาไม่ได้ เช่น เราจะไม่ทดลองยาที่ต้องวัดผลในระยะ 5 ปี ในคนที่อาจมีชีวิตอยู่ได้ไม่นาน
3. ผู้ป่วยหรือประชากรจะต้องไม่แพ้ยา หรือสารเคมีที่จะศึกษา หรือโรค หรือสภาพร่างกาย ที่อาจจะทำให้ตรวจสอบ ภาวะแทรกซ้อนยาไม่ได้ ตัวอย่างเช่น เราจะไม่ทดลองยา ที่มีโอกาสทำให้อาการตาบอดในเด็กเล็ก ๆ เพราะเด็ก ไม่สามารถบอกเราได้ว่า ตาตัวเองเริ่มมองไม่เห็น
4. ผู้ป่วยหรือประชากร จะต้องวัดผลการทดลองได้ไม่ยาก เช่นจะต้องไม่อยู่ในแดนผู้ก่อการร้าย เพราะถ้าเกิดผู้ป่วยไม่มาหา จะได้สามารถติดตาม
5. ผู้ป่วยจะต้องยินยอมทำตามคำแนะนำของแพทย์ ฉะนั้น หากผู้ป่วยเป็นผู้ติดสุราเรื้อรัง หรือผู้ป่วยทางจิตประสาท ติดยาเสพติด ก็ไม่นำมาศึกษา
ในผู้ป่วยหรือประชากรที่คัดเลือกเข้ามานั้น สิ่งที่จะต้องบันทึกให้ละเอียดก็คือ "ตัวกวน" หรือ Confounder ซึ่งได้แก่ปัจจัยเสี่ยง และโรคร่วม ที่มีผลต่อสิ่งที่จะวัด เช่น ถ้าสิ่งที่จะวัดคือ อัตราตาย ปัจจัยเสี่ยงได้แก่ ผู้ที่มีอายุมาก โรคร่วมได้แก่ การเป็นมะเร็งในร่างกาย เพราะทั้งอายุ และมะเร็ง มีผลต่อร่างกาย
3.2 การแบ่งกลุ่มผู้ป่วย
เป้าหมายใหญ่ของการแบ่งกลุ่มผู้ป่วย คือ ต้องการให้กลุ่มทดลอง และกลุ่มควบคุม มีอัตราเสี่ยงของโรคร่วม ที่มีผลต่อตัววัดเท่ากัน นักวิจัยจะต้องรู้ว่า ผู้ป่วยทุกคน ต้องมีโอกาสถูกเลือกเข้ารับการรักษาชนิดใหม่ และการรักษามาตรฐานเดิมเท่ากัน และนักวิจัยจะต้องทราบ โอกาสที่ผู้ป่วยถูกเลือกด้วย ถ้าโอกาสถูกเลือกเท่ากับ 50% ก็จะเหมือนกับการโยนหัวก้อย กระบวนการที่คล้ายกับการโยนหัวก้อย หรือ กระบวนการแบ่งกลุ่ม ที่ผู้ป่วยมีโอกาสถูกเลือกเท่ากันนี้ เรียกว่า Random Allocation เป็นวิธีการที่จะลดอคติในการแบ่งกลุ่ม ทั้งในส่วนที่ผู้วิจัยสามารถเห็น และมองเห็นไม่ได้ ไม่ใช่เฉพาะอคติส่วนที่มองเห็นได้แต่อย่างเดียว ถ้าการแบ่งกลุ่มผู้ป่วยดี และถ้าผลการวิจัยบ่งว่าการรักษาได้ผลดี หลักฐานที่ได้ ก็ไม่น่าจะเกิดจากอคติในการเลือกผู้ป่วย
ต่อไปนี้จะได้ลองยกตัวอย่างอคติที่เกิดขึ้นในการวิจัย ที่ไม่ใช่เป็น randomized trial เช่น การศึกษาว่ายา Rifampicin (RF) ที่ให้ร่วมกับ Isoniazid (INH) รักษาวัณโรคปอดจะดีกว่า Isoniazid+Ethambutal (ETB) หรือไม่ เราอาจได้ผลตามตาราง
ตารางที่ 1
| ผล | ยา | ||
| INH + RF | INH + ETB | รวม | |
| หาย | 80 | 95 | 175 |
| ไม่หาย | 20 | 5 | 25 |
| รวม | 100 | 100 | 200 |
ดูคล้ายกับว่า ยา INH+ETB ให้ผลดีกว่า INH + RF แต่ถ้าซักประวัติให้ดี อาจจะพบว่า ผู้ป่วยกลุ่ม INH +RF มีโรคเบาหวานร่วมผู้ ร้อยละ 80 ในขณะที่ในกลุ่มที่ได้รับยา INH+ETB มีโรคเบาหวานร่วมเพียง ร้อยละ 10 เมื่อเป็นเช่นนี้ ถือว่าโรคเบาหวานเป็น "ตัวกวน" หรือ confounder ที่ทำให้ผลสรุปของงานวิจัยไม่ถูกต้อง ทั้งนี้เพราะ โรคเบาหวานมีลักษณะที่สำคัญ 3 ประการคือ
ก. เบาหวานเป็นสิ่งที่อยู่นอกคำถามการวิจัย เพราะผู้วิจัยถามเรื่องยาชนิดต่าง ๆ กับการหายของวัณโรคปอด ไม่ใช่ถามเกี่ยวกับเบาหวาน
ข. เบาหวานมีความสัมพันธ์กับวัณโรคปอด คือ ผู้ป่วยเบาหวานมีโอกาสเป็นวัณโรคปอดได้ง่าย และเมื่อเป็นแล้วหายยาก
ค. เบาหวานมีการกระจายไม่เท่ากันในกลุ่มทดลองและกลุ่มควบคุม
ในทางการการแพทย์สิ่งที่ถือว่าเป็น "ตัวกวน" อาจจะมีลักษณะดังนี้
ก. ลักษณะจำเพาะของผู้ป่วยที่อาจจะเสี่ยงต่อโรค เช่น ถ้าจะศึกษาการเกิด Myocardial infarction กับการออกกำลังกาย อายุจะเป็นตัวกวนที่สำคัญ กล่าวคือ าอายุมากก็มีโอกาสตายจาก myocardial infarctionมาก โดยไม่เกี่ยวกับว่า จะออกกำลังกายหรือไม่
ข. โรคที่เกิดขึ้นร่วมกัน ตัวอย่างเช่น โรคเบาหวาน อาจเป็นตัวกวนในการวิจัยเกี่ยวกับ การรักษาวัณโรค ดังได้กล่าวแล้ว
ค. ยาที่ให้ร่วมกัน เช่น ยา Steroid อาจเป็นตัวกวน ในการทดลองยารักษา วัณโรคเยื่อหุ้มสมองอักเสบ
ง. ความรุนแรงของโรคที่ศึกษา ผู้ป่วยที่มีโรครุนแรง อาจจะตอบสนองต่อการรักษา ไม่เหมือนกับผู้ป่วยที่เป็นโรคน้อย ความรุนแรงของโรค จึงอาจเป็นตัวกวนที่สำคัญได้
การทำ random allocation เป็นวิธีการที่จะแบ่งกลุ่มตัวอย่างเป็นกลุ่มทดลอง และกลุ่มเปรียบเทียบ โดยมุ่งหวังให้มีการกระจายของตัวกวน ในกลุ่มทดลอง และกลุ่มเปรียบเทียบใกล้เคียงกัน ไม่ว่าจะเป็นตัวกวนที่เราคาดถึงหรือไม่ก็ตาม
นอกจาก random allocation วิธีการอื่นที่ใช้ในการแบ่งกลุ่มผู้ป่วยออก มีอีกหลายวิธี เช่น
1) ใช้การจับคู่เลือกกลุ่มเปรียบเทียบ ให้มีปัจจัยที่อาจเป็น "ตัวกวน" หรือ confoundeer ให้คล้ายคลึงกับผู้ป่วย (Matching)
2) การให้ผู้ป่วยเลือกกลุ่มเอาตามความสมัครใจ
3) การใช้ Crossover design
4) Latin Square
5) Factorial design และ
6) Sequential design
แบบแผนการวิจัยแต่ละอย่าง เหมาะสมสำหรับลักษณะคำถาม และโรคที่ศึกษา เช่น sequential design นิยมใช้กับโรคที่เห็นผลการรักษา หลังจากที่ผู้ป่วยได้รับยาไม่นาน ส่วนผู้ป่วยที่เป็นโรคเรื้อรัง เช่น rheumatioid arthritis, parkinson’s disease อาจต้องศึกษาโดยใช้ crossover design สำหรับ crossover design เราศึกษาตัวอย่างจำนวนน้อย แต่ละตัวอย่างได้รับการรักษาต่างกันในแต่ละช่วงเวลา ทำให้ผู้ป่วยแต่ละคน เป็นเป็นตัวเปรียบเทียบการรักษาต่างชนิดได้ (within patient control) ในขณะที่เปลี่ยนยา ต้องระวังว่าอาการต่าง ๆ ของผู้ป่วย อาจเกิดจากฤทธิ์ยาเดิมยังไม่หมด (carry over effect) ซึ่งแก้ไขได้โดย ให้มีระยะพักที่ผู้ป่วยได้รับยาปลอม (placebo) ในระหว่างเปลี่ยนยา ระยะพักนี้เรียกว่า wash out period
การทำ random assignment มีหลายวิธี เช่น simple randomization, blocked randomization, stratified randomization และ adaptive randomization ในทุก ๆ วิธีการ ผู้ป่วยมีโอกาสถูกเลือกเข้ากลุ่มศึกษาแต่ละกลุ่มเท่ากัน ยกเว้นวิธี adaptive randomizaiton ในวิธี adaptive randomization โอกาสที่ผู้ป่วยถูกเลือกเข้ากลุ่มศึกษา จะเปลี่ยนแปลงเสมอ ขึ้นกับความสมดุลย์ระหว่างกลุ่ม ในเรื่องปัจจัยต่าง ๆ ที่อาจเป็น confounder กล่าวคือ ถ้ากลุ่มใดมีผู้ป่วยปัจจัยเสี่ยงหนึ่ง ๆ น้อยกว่าอีกกลุ่มมาก โอกาสที่ผู้ป่วยที่มีปัจจัยเสี่ยงนั้น ๆ จะถูกเลืกเข้ากลุ่มนั้น ก็มีมากขึ้น วิะนี้ เหมาะสำหรับการศึกษาที่มีปัจจัยที่เป็น confounder มาก แต่จำนวนวนผู้ป่วยมีน้อย Adaptive radomization อาจจะแบ่งได้อีกหลายชนิด เช่น biased coin randomization, play the winner procedure, two armed bandit method, และ minimization. รายละเอียดของแต่ละวิธีการ มีมากเกินว่าที่จะกล่าว ในที่นี้ จึงจะขอเน้นเฉพาะ วิธีการแบ่งกลุ่มผู้ป่วยมีโอกาสถูกเลือกเข้ากลุ่มแต่ละกลุ่มเท่ากัน เท่านั้น ดังรายละเอียดต่อไปนี้
3.2.1 Simple Randomiztion เป็นวิธีแบ่งกลุ่มผู้ป่วยอย่างง่าย เช่น การใช้ตาราง random number table หรือการโยนหัวก้อย ในปัจจุบันมีเครื่องคิดเลขจำนวนมาก ที่สร้าง random number เพื่อแบ่งกลุ่มผู้ป่วยได้โดยเฉพาะ ถ้าต้องแบ่งกลุ่มผู้ป่วยจำนวนมาก
ตัวอย่างเช่น ต้องการเปรียบเทียบฤทธิ์ของ ยา ก. และ ข. ในผู้ป่วย typhoid จำนวน 20 ราย และต้องการให้ผู้ป่วยแต่ละคน มีโอกาสได้รับยาแต่ละอย่าง เท่ากัน เราก็สามารถหาตาราง random number และเลือกจุดเริ่มต้นจุดไหนก็ได้ แต่ต้องอ่านเลขให้เป็นระบบ เช่น เลือกอ่านตามแนวนอนหรือ แนวยืน อย่างใดอย่างหนึ่ง อ่านเรียงไป 20 หมายเลขก็จะครบตามจำนวนที่ต้องการ และกำหนดในใจล่วงหน้าว่า ถ้าได้เลขคู่ ผู้ป่วยจะได้รับยา ก. แต่ถ้าได้เลขที่คี่ ผู้ป่วยจะได้รับา ข. เป็นต้น หรืออาจใช้เกณฑ์ว่า ถ้าต้องเลขอยู่ระหว่าง 00-49 ผู้ป่วยได้รับยา ก. และถ้าตัวเลขระหว่าง 50-99 ผู้ป่วยได้รับยา ข. ก็ได้ ถ้าใช้เครื่องคิดเลขทำ random number ก็ใช้ได้เลข ไม่ต้องไปหาตาราง แต่ต้องกำหนดเกณฑ์การแบ่งกลุ่มไว้ล่วงหน้า อย่างเป็นระบบคล้ายคลึงกัน
วิธีนี้ได้ง่าย ข้อเสียงสำคัญอยู่ที่ว่า จำนวนผู้ป่วยในแต่ละกลุ่ม อาจจะต่างกันมาก โดยเฉพาะ กรณีที่จำนวนผู้ป่วยทั้งหมดที่จะใช้ มีน้อยกว่า 100 คน ทำให้อำนาจในการวิเคราะห์ทางสถิติเสียไป
3.2.2 Blocked randomization เป็นวิธีที่แบ่งผู้ป่วยเป็นกลุ่มย่อย (block) เสียก่อน เช่นกลุ่มละ 4 หรือ 8 คน ในแต่ละ block มีความสมดุลย์ระหว่างการรักษาชนิดต่าง ๆ แต่การเรียงตัวของชนิดการรักษาจะไม่แน่นอน วิธีนี้เป็นการเลี่ยงปัญหาที่เกิดจาก จำนวนผู้ป่วยในแต่ละกลุ่มไม่เท่ากัน ซึ่งพบใน simple randomization
สมมุติกำหนดขนาด block เท่ากับ 4 เพื่อศึกษายา ก. และ ยา ข. เราต้องมาถามก่อนว่าการเรียงลำดับของยา ก. และยา ข. ในผู้ป่วยกลุ่มละ 4 คน ทำได้กี่วิธี คือ ต้องมาหา จำนวน ของการเรียงลำดับก่อน ดังนี้
จำนวนที่เรียงลำดับได้ = N! (T! x(N - T!) โดยที่ N = ขนาดของ block = 4 T = จำนวนการรักษาที่ศึกษา = 2 (ก และ ข) = (1x2x3x4) / (1x2 x 1x2) = 24 / 4 = 6
หมายความว่า การเรียงลำดับยา ก. และยา ข. ในขนาด block 4 คน ทำได้ 6 วิธี ดังนี้ คือ กกขข กขกข ขกกข ขกขก ขขกก และ กขขก
ขั้นต่อไป เราก็ให้หมายเลข 1 ถึง 6 แก่วิธีเรียงลำดับยา ก. และข. ในแต่ละ block (1=กกขข, 2=กขกข, 3=ขกกข, 4=ขกขก, 5=ขขกก, 6=กขขก) และใช้วิธี simple randomization เลือกหมายเลขเหล่านี้ ออกมาอีกทีหนึ่ง สมมุติว่า เลือกได้หมายเลข 5 3 5 1 4 สำหรับคนไข้ Typhoid 20 ราย การเรียงตัวของยาที่ได้จะเป็นดังนี้
5=ขขกก 3=ขกกข 5=ขขกก 1=กกขข 4=ขกขก
ขขกก ขกกข ขขกก กกขข ขกขก
ในกรณีเช่นนี้ คนไข้รายแรกจะได้ยา ข. รายที่ 2 ได้ยา ข. รายที่ 3 ได้ยา ก. และรายที่ 20 ได้ยา ก. ด้วยวิธีนี้ แม้คนไข้ จะมีจำนวนน้อย โอกาสที่จำนวนคนไข้ในแต่ละกลุ่มการรักษาจะต่างกัน จะมีไม่มาก ข้อเสียงสำคัญอยู่ที่ว่า หากคนจัดผู้ป่วยเข้ากลุ่ม รู้ขนาด block ก็จะทำให้เดาการรักษาที่ผุ้ป่วยจะได้รับ ได้ทุกคนที่ 4 ซึ่งก็แก้ไขได้ โดยเปลี่ยนขนาด block ตลอดเวลา หรือปิดขนาดของ block ไว้เป็นความลับ
วิธีการทางสถิติที่ใช้วิเคราะห์ข้อมูล มักถือว่า การแบ่งกลุ่มเป็นแบบ Simple randomization การทำ block randomization ทำให้อำนวจการวิเคราะห์ทางสถิติ ต่ำลงไป กล่าวคือ ค่า p-value ที่ได้ มักจะต่ำกว่าความเป็นจริง แต่การคำนึง เรื่อง block ด้วย ทำให้มีความยุ่งยากในการวิเคราะห์มาก และไม่นิยมทำกัน
3.2.3 Stratified Randomization เป้าหมายอันหนึ่ง ของการแบ่งผู้ป่วยออกเป็นกลุ่มต่าง ๆ ก็เพื่อให้ความสมดุลย์ระหว่ากลุ่ม นปัจจัยที่อาจมีผล ต่อตัววัดที่น่าสนใจ (prognostic factors) ซึ่งอาจเป็นปัจจัยเสี่ยง (risk factors), โรคร่วม (comorbidity), ระยะโรค (Stage of disease), ความรุนแรงของโรค (disease severity) รวมทั้งการรักษาที่ให้ร่วมกัน (concomitant treatment) เพื่อให้แน่ใจว่า สัดส่วนของผู้ป่วยที่มีปัจจัยเหล่านี้ ในแต่ละกลุ่ม ใกล้เคียงกัน เราอาจจะต้องพิจารณาแบ่งผู้ป่วย ออกเป็นกลุ่มย่อย ตามปัจจัยที่เป็น "ตัวกวน" เหล่านี้ กลุ่มย่อยที่แบ่งได้ เรียกว่า strata แล้วจึงทำ simple randomization หรือ block randomization ในแต่ละ strata อีกหนึ่ง การทำเช่นนี้ จะทำให้จำนวนผู้ป่วยที่มี confounder แต่ละอย่าง สมดุลย์กันในกลุ่มต่าง ๆ
โดยทั่วไป เรามักจะเลือกปัจจัยที่อาจเป็น confounder ไม่เกินสามปัจจัย มาทำเป็น strata จำนวน strata จะมากน้อย ขึ้นกับจำนวน confounders ที่ใช้ และจำนวนกลุ่มการแบ่ง ของแต่ละ confounder เช่น ต้องการทดลองยา aspirin ในการป้องกัน thromboembolism ในผู้ป่วยโรคหัวใจรูมาร์ติก Confounders ที่จะใช้ได้แก่ ช่วงอายุ (30 - 40, 45 -59, และ > 60) และ atrial fibrillation (มีหรือไม่มี AF) strata หรือกลุ่มย่อยที่แบ่งได้จะเป็นดังนี้
อายุ 30 - 44 มี AF ไม่มี AF 45 - 59 มี AF ไม่มี AF > 60 มี AF ไม่มี AF
กลุ่ม 1 ได้แก่ผู้ป่วยที่มีอายุ 30 - 44 ปี และ มี AF กลุ่ม 2 ได้แก่ผู้ป่วยที่มีอายุ 30 - 44 ปี และ ไม่มี AF กลุ่ม 3 ได้แก่ผู้ป่วยที่มีอายุ 45 - 59 ปี และ มี AF กลุ่ม 4 ได้แก่ผู้ป่วยที่มีอายุ 45 - 59 ปี และ ไม่มี AF กลุ่ม 5 ได้แก่ผู้ป่วยที่มีอายุ > 60 ปี และ มี AF กลุ่ม 6 ได้แก่ผู้ป่วยที่มีอายุ > 60 ปี และ ไม่มี AF
ผู้ป่วยในกลุ่มย่อยแต่ละกลุ่ม จะถูกแบ่งออกเป็น พวกที่ได้รับ aspirin และ placebo ด้วยวิธี simple randommization หรือ blocked randomization อีกทีหนึ่ง
เหตุที่ไม่นิยมใช้ confounders มากกว่า 3 ชนิด มาทำ stratifcation ก็เพราะว่า การทำเช่นนี้ จะมีจำนวนกลุ่มย่อย มากเกินไป จำนวนผู้ป่วยในแต่ละกลุ่มยอ่ย จะมีน้อยเกินไป ทำให้เกิดความไม่สมดุลย์ ของจำนวนผู้ป่วย ที่ได้รับการรักษา ชนิดต่าง ๆ ในแต่ละกลุ่มย่อย เช่น หากมีทั้งหมด 20 strata และผู้ป่วยทั้งหมด มี 60 คน ในแต่ละ strata ก็จะมีผู้ป่วยโดยเฉลี่ย เท่ากับ 60 / 20 หรือ 3 คน ไม่พอที่จะแบ่งเป็นกลุ่มได้รับยาจริง หรือยาปลอม เป็นต้น
3.3 รายละเอียดเกี่ยวกับวิธีการทำการศึกษา (Manoeuver)
สิ่งสำคัญที่จะต้องพิจารณาในข้อนี้มี 5 ประการ
ประการที่ 1 ต้องให้รายละเอียด ของกระบวนการป้องกัน และการให้การรักษาชนิดใหม่ เพียงพอที่ผู้อื่นจะทำซ้ำได้ ต้องตอบคำถามได้ว่า ใคร ทำอะไร ให้ใคร ใช้สูตร หรือใช้เกณฑ์อะไร ยาขนาดไหน ให้ในสภาพอะไร มีการปรับขนาดยาหรือไม่ และมีการวัดการตอบสนอง ต่อการรักษา หรือภาวะแทรกซ้อนของยา ถี่เพียงพอหรือไม่ วัดเป็นเวลาเท่าใด และใช้เกณฑ์อะไร ในการบอกว่า ควรจะหยุดการรักษา หรือหยุดยานั้น ๆ
ประการที่ 2 กระบวนการป้องกัน และการรักษาชนิดใหม่ ควรเข้ากับความจริงทางวิทยาศาสตร์ ที่ทราบกันอยู่ในปัจจุบัน เช่น ขนาดยา วิธีการให้ยา การทำลายยาในร่างกายโดยตับ หรือโดยไต ในทำนองเดียวกัน การให้ยาหลาย ๆ อย่างร่วมกัน จะต้องมีเหตุผลทางคลินิก ที่อธิบายได้
ประการที่ 3 กระบวนการป้องกัน และการรักษาใหม่ จะต้องหาได้ไม่ยากนัก ผู้ป่วยต้องยอมรับ และมีความสามารถหาไว้ใช้ได้
ประการที่ 4 การควบคุมอคติในการให้การป้องกัน และการรักษา จะต้องทำได้ดีพอ อคติในกรณีนี้ ที่สำคัญมี 2 ชนิด
ก. Co-intervention คือ อคติที่เกิดจาก การเพิ่มการวินิจฉัย การรักษา หรือการให้ความสนใจในลักษณะใด ๆ กับกลุ่มทดลอง หรือกลุ่มควบคุม อย่างใดอย่างหนึ่ง เพียงกลุ่มเดียว โดยไม่ได้ให้การวินิจฉัย การักษา หรือความสนใจทำนองเดียวกัน อีกกลุ่มหนึ่ง เช่น หากเรามีความเชื่อว่า ยาใหม่น่าจะให้ผลดีกับผู้ป่วยโรคหัวใจต ถ้าเรารู้ว่า ผุ้ป่วยคนใดได้รับยาใหม่ เราก็อาจจะดูแลเป็นพิเศษ ให้แพทย์และพยาบาลเฝ้าเป็นพิเศษ ใช้เครื่องช่วยหายใจ หรือเครื่องวัดคลื่นไฟฟ้าหัวใจ ตรวจสอบอาการผู้ป่วยตลอดเวลา โดยที่เราไม่ได้ทำเช่นเดียวกัน ในผู้ป่วยกลุ่มเปรียบเทียบ ที่ได้รับยามาตรฐาน ผลการรักษา ก็อาจจะสะท้อนถึง การวินิจฉัย และการรักษาที่ให้มา ร่วมกับยาที่ทดสอบ ไม่ใช่เป็นฤทธิ์ของยา ที่ทดสอบแต่เพียงอย่างเดียว
ข. Contamination คือ อคติที่เกิดจาก การที่กลุ่มควบคุม หรือกลุ่มทดลอง ที่ควรได้เฉพาะการรักษามาตรฐาน หรือยาใหม่เพียงอย่างเดียว แต่กลับได้รับการป้องกัน หรือการรักษาของอีกกลุ่มหนึ่ง ในกรณีเช่นนี้ ถ้าการรักษาใหม่ได้ผลดี แต่กลุ่มบางคนได้รับยาใหม่ด้ย ผู้วิจัยจะพบว่า ขนาดความแตกต่างระหว่างการรักษาใหม่ กับการรัาามาตรฐาน จะทดลอง ในทำนองเดียวกัน ถ้ากลุ่มทดลองไปได้รับยาทดลองที่กลุ่มเปรียบเทียบควรจะได้รับถือว่าเป็น contamination ด้วยเพราะมีผลทำให้ความแตกต่างระหว่างยาที่ทดสอบลงด้วย
ทั้ง Co-intervention และ Contamination จะควบคุมได้ โดยการให้ผู้ป่วย และแพทย์ผู้ให้การรักษา ไม่ทราบว่า ผู้ป่วยได้รับการรักษาแบบใหม่ หรือการรักษามาตรฐาน โดยขบวนการที่เรียกว่า double blind นอกจากนี้ ต้องมีเกณฑ์ในการดูแลผู้ป่วยเป็นพิเศษ ให้ชัดเจนด้วย และปฏิบัติให้เหมือนกัน ทุกกลุ่มที่ศึกษา
ประการที่ 5 ผู้ป่วยจะต้องปฏิบัติตามขั้นตอนการรักษาเพียงพอ (compliance) ในการทดลองยา Complinance คือ การดูว่าผู้ป่วย หรือประชากร ต้องปฏิบัติตามวิธีป้องกัน หรือรักษาใหม่ และการป้องกัน หรือการรักษาตามมาตรฐาน อย่างถูก้องครบถ้วน ข้อพิจารณานี้ มีความสำคัญ สำหรับโรคเรื้อรั ที่ต้องรักษาเป็นเวบานาน และางขั้นตอนของการรักษา ผู้ป่วยมิได้อยู่โรงพยาบาล ตัวอย่าง เช่น ในการเปรียบเทียบ ยารักษาวัณโรคปอด หากผู้ป่วยรับประทานยาแล้ว อาการดีขึ้น เมื่อได้กลับบ้าน ต้องไปรับประทานยาต่อ แต่ผู้ป่วย อาจจะไม่รับประทานยาตามแพทย์สั่ง เพราะเห็นว่า อาการของตนไม่มีแล้ว ผู้ป่วยอาจจะหยุดยาเอง ทั้ง ๆ ที่โรคยังไม่หาย ทำให้การทดสอบฤทธิ์ของยาไม่ได้ผล รายละเอียดเกี่ยวกับสาเหตุ และวิธีการเพิ่ม compliace มีในเรื่องการใช้ผลของ clinical trial ในชีวิตประจำวัน
3.4 การติดตามผลการรักษา
ระยะเวลาของการศึกษา เป็นสิ่งที่สำคัญ ในข้อพิจารณานี้ เพราะในปัจจุบัน โรคส่วนใหญ่ มักจะไม่หายในโรงพยาบาล จะต้องมีการติดตามผู้ป่วย เพื่อดูผลการรักษา เป็นเวลาหลายปี ยิ่งมีการติดตามผู้ป่วยนาน โอกาสที่ผู้ป่วยที่สมัครเข้ารับการรักษา จะถอนตัวออกจากการรักษา ก็มีมาก การถอนตัว อาจจะเกิดขึ้นได้ หลายกรณี เช่น ย้ายถิ่นที่อยู่ เปลี่ยนวิธีการรักษาโรค เป็น วิธีที่ไม่ได้กำหนดไว้ ในแผนการทดลอง เช่น ไม่ยอมกินยาที่แพทย์สั่ง แล้วเปลี่ยนไปรักษากับหมอพระ เป็นต้น จำเป็นทีผู้วิจัย จะต้องกำหนดให้ดีว่า สถานการณ์เช่นใด ที่ถือได้ว่าผู้ป่วย ถอนตัวออกจากการทดลอง เพราะสิ่งเหล่านี้ จะต้องนำมาพิจารณา ในการวิเคราะห์ทางสถิติ ในการวิเคราะห์ทางสถิติ จะต้องพิจารณาผู้ป่วยทั้งหมด ที่ถูกคัดเลือกมา โดยอาศัยเกณฑ์การคัดเลือก ที่วางไว้ล่วงหน้า มิฉะนั้น จะเกิดปัญหา ดังตัวอย่างตาราง 12.2
ตาราง 2 ผลการรักษาผู้ป่วยที่เป็นอัมพาตชั่วคราวด้วยวิธีผ่าตัดและรักษาทางยาในผู้ป่วยที่ "available for follow-up"
| Outcome | Rx | ||
| Surgical | Medical | Total | |
| ตายหรืออัมพาต | 43 | 53 | 96 |
| ไม่ตาย,ไม่เป็นอัมพาต | 36 | 19 | 55 |
| Total | 79 | 72 | 151 |
Risk recuction = (53 / 72 -
43 / 79) / (53 / 72) = 27%
ที่มา : ดัดแปลงจาก JAMA 211 : 1993 - 2003, 1970.
จากตาราง 12.2 ผู้วิจัยรายงานผลการรักษาผู้ป่วยเฉพาะที่ "available for follow-up" ผลการวิจัยบ่งว่า การผ่าตัด สามารถลดอัตราตาย หรือเป็นอัมพาตลง 27% ความแตกต่างนี้ มีความสำคัญทางคลินิก และทางสถิติ (P = 0.02) แต่ถ้าพิจารณาผลการรักษา ในผู้ป่วยที่ถูกเลือก เข้าในโครงการวิจัยตั้งแต่แรก จะได้ผลตามตาราง 12.3 เมื่อเปรียบเทียบจำนวนผู้ป่วย ในตารางที่ 12.3 กับตารางที่ 12.2 จะพบว่า จำนวนผู้ป่วยที่ตายเพิ่มขึ้น ในกลุ่มที่รักษาโดยผ่าตัด มีถึง 15 คน (58-53) แต่จำนวนผู้ป่วยที่ตายเพิ่มขึ้น ในกลุ่มที่ได้รับการรักษาทางยา ที่เพียง 1 คน (54-53) ฉะนั้น ในการวิเคราะห์ผล ตามตาราง 12.2 ผู้วิจัยพิจารณาเพียง ผู้ป่วยที่ไม่ได้ตายระหว่างการผ่าตัด ผู้ตายระหว่างการผ่าตัด ไม่มีชีวิตอยู่ให้ติดตามผลการรักษาได้ ในความเป็นจริง การที่ผู้ป่วยจะตัดสินใจว่า จะรักษาด้วยวิธีการผ่าตัด หรือทางยา จำเป็นต้องพิจารณาถึงอัตราเสี่ยง ระหว่างผ่าตัดด้วย มิใช่เฉพาะอัตราเสี่ยง ของผู้ป่วยที่รอดจากการผ่าตัด มาให้แพทย์ติดตามได้เท่านั้น
ตารางที่ 3
| Outcome | Rx | ||
| Surgical | Medical | Total | |
| ตายหรืออัมพาต | 58 | 54 | 112 |
| ไม่ตาย,ไม่เป็นอัมพาต | 36 | 19 | 55 |
| Total | 94 | 73 | 167 |
Risk reduction = (54 / 73 - 58 / 94) / (54 / 73) = 16%
ถ้าพิจารณาผลการรักษาผู้ป่วยทั้งหมด ตามตาราง 12.3 ผลการวิจัยบ่งว่า การผ่าตัดสามารถลดอัตราตาย หรือเป็นอัมพาตลง 16% ความแตกต่างนี้ ไม่มีนัยสำคัญทางสถิติ (P=0.09)
ตัวอย่างนี้ จึงชี้ให้เห็นได้ชัดเจนว่า ในการวิเคราะห์ข้อมูล ควรจะใช้ผู้ป่วยทั้งหมด หากมีความจำเป็น ต้องตัดผู้ป่วยบางส่วนออกไป ต้องแสดงให้เห็น ถึงผลกระทบที่เกิดจากการตัดนั้น ต่อการสรุปเกี่ยวกับ ผลดีและเสีย ที่เกิดจากการรักษา ถ้าการตัดผู้ป่วยออก ไม่ให้ผลสรุป ต่างไปจากผลสรุป เมื่อวิเคราะห์ผู้ป่วยออกทั้งหมด ก็เป็นที่น่ายินดี เพราะแสดงว่า ผลการศึกษมีความคงที่สามารถซ้ำได้ แต่ถ้าผลสรุป ที่เกิดจากการตัดผู้ป่วยออก ไม่ได้ผลดี ผู้อ่านก็ควรมีโอกาสพิจารณาเลือกว่า ตนจะเชื่อการสรุปชนิดใด
3.5 ตัววัดที่บ่งชี้ถึงผลการวิจัย
ตัววัดที่ให้ประเมิน "ผลดี" ของการรักษาพยาบาลมีหลายอย่าง ดังนี้
3.5.1 พิจารณาจากความรู้สึกของแพทย์หรือผู้ป่วย (subjective assessment) เช่น ผู้ป่วยรู้สึกว่า หาย สบายขึ้น หรือแพทย์มีความรู้สึกว่า ยาที่ใช้รักษาเบาหวาน ควบคุมระดับน้ำตาลในเลือดไม่ใคร่ได้ เป็นต้น
3.5.2 พิจารณาจากข้อมูลที่รวบรวมได้จริง โดยไม่ได้ใช้ความรู้สึก (Objective assessment) เช่น ค่าระดับน้ำตาลนเลือด เป็นมิลลิกรัมเปอร์เซนต์ ระยะเวลาตั้งแต่ได้รับยา จนไข้ลง (duration to specific result) หรือระยะเวลาตั้งแต่ได้รับยา จนมีภาวะแทรกซ้อนจากยา เป็นต้น
สำหรับ objective assessment อาจมีตัววัดที่มีความสำคัญทางคลินิกหลายประการ เช่น การเปลี่ยนแปลงระดับสารเคมีในเลือด ความรุนแรงของโรค การตาย การเกิดเป็นโรคใหม่ ความทุกข์ทรมานของผู้ป่วย ความขัดแย้งในครอบครัว ที่เกิดจากการเป็นโรค รวมทั้งความสะดวก ในการรับการรักษาพยาบาล ตัววัดบางตัวเกี่ยวเนื่องกัน เช่น ระดับ choloesterl และการตายจากเส้นเลือดหัวใจตีบ จากที่มีระดับไขมันสูง ในกรณีเช่นนี้ ระดับ choloesterl เป็นตัววัดขั้นต้น (serrogate outcoMe) และการตายจาก myocardial infarction เป็นตัววัดขั้นสุดท้าย (final outcome) ในการวิจัย อาจจะต้องเลือก serrogate outcome เป็นตัววัดหลัก เพราะเกิดได้ง่ายกว่า ทำให้จำนวนตัวอย่างที่ต้องการก็ไม่มาก การใช้ final outcome เลย อาจจะทำยาก เพราะอัตราการเกิดมีน้อย อาจต้องใช้ตัวอย่างมาก และติดตามนาน
ขอยกตัวอย่าง การศึกษายาที่ใช้รักษาที่ใช้รักษาอัมพาต ที่เกิดจากเส้นเลือดสมองตีบ ว่าจะทำให้อัมพาตดีขึ้นหรือไม่ โดยมีการทดสอบยา A และ B ปรากฏผลตามตาราง
| ตัววัด | ||
| A | B | |
| การเปลี่ยนแปลงคลื่นไฟฟ้าสมอง | + 1% | - 9% |
| อัมพาตดีขึ้น | 50% | 5% |
| อัตราตาย | td align="center" width="100">50%5% |
+ หมายถึง ดีขึ้น
- หมายถึง เลวลง
จากตัวอย่าง เห็นได้ว่า ถ้าพิจารณาการเปลี่ยนแปลงคลื่นไฟฟ้าสมอง หรือการเปลี่ยนแปลงของอาการอัมพาต ยา A ดูเหมือนจะดีกว่ายา B แต่ถ้าพิจารณาอัตราตายด้วย จะพบว่า ยา A เกิดร่วมกับการตายด้วย ถึงร้อยละ 50 ในขณะที่ผู้ป่วยทีได้ยา B มีอัตราตาย 5% ข้อมูลนี้บ่งว่า ถ้าจะใช้ยา A ต้องเตรียมใจเรื่องว่า อาจจะตาย ถ้าเกิดไม่ตาย ก็มีโอกาสดีขึ้น แต่ถ้าใช้ยา B โอกาสตายมีน้อย แต่ถ้าโอกาสดีขึ้นก็มีน้อย เมื่อมีเช่นนี้จะสรุปว่ายา A ดีกว่า ยา B ย่อมไม่ได้ และจะสรุปว่ายา A หรือยา B มีประโยชน์ต่อการรักษาอัมพาตมากกว่ามีโทษ ก็ไม่ได้เช่นเดียวกัน ในกรณีที่ไม่มียาอื่น แพทย์ไม่ควรใช้ยาทั้ง ยา A และ ยา B นอกจากจะพิสูจน์ได้ว่า ถ้าไม่รักษา อัตราตายมีมากกว่าร้อยละ 5 และในคนที่มีชีวิตอยู่ อัมพาตดีขึ้นน้อยมาก
ตัววัดที่สำคัญทางคลินิกทุกตัว อาจจะสามารถวัดได้แม่นยำต่าง ๆ เช่น ระดับความไม่รู้สึกตัว จะวัดยากกว่า ระดับน้ำตาลในเลือด ฉะนั้นในการพิจารณาคุณค่า และความถูกต้องของตัววัด จึงต้องถามว่า
1. ตัววัดนั้นเหมาะสมที่จะตอบคำถามการวิจัยหรือไม่ (relevancy)
2. มีวิธีปฏิบัติที่ชัดเจนในการวัดหรือไม่ (Capability of operational definition)
3. ผู้ที่จะใช้และให้บริการทางการแพทย์ยอมรับตัววัดหรือไม่ (Credibility)
4. สามารถวัดได้ถูกต้อง (accurate) เชื่อถือได้ (valid) และปราศจากอคติ (Unbias) หรือไม่
ฉะนั้น ตัววัดที่มีคำจำกัดความตัววัดชัดเจน (explicit objective criteria) และ/หรือ ผู้วัดและผู้ถูกวัด ไม่ทราบว่าผู้ป่วย ได้รับการรักษาชนิดใด (double blind) ก็ย่อมมีโอกาสถูกต้อง เชื่อถือได้ และปราศจากอคติ มากกว่าตัววัด ที่ไม่มีคุณสมบัติดังกล่าว
การ blind ผู้วัด และผู้ถูกวัด ไม่ใช่ทำเฉพาะขั้นตอนของการวัดเท่านั้น แท้ที่จริง ในขั้นตอนการแบ่งกลุ่มผู้ป่วย การให้การรักษา หรือการป้องกันโรค การติดตามผลการรักษา และการวัดผลการรักษา จำเป็นที่แพทย์และผู้ป่วย จะต้องไม่ทราบ เกี่ยวกับกลุ่มที่แบ่ง และการรักษาที่ได้รับ (double blind) เพื่อสามารถวัดผลการวิจัยได้ โดยปราศจากอคติ ในบางโครงการ นักนิสิตก็อาจจะไม่ทราบกลุ่มที่ศึกษาด้วย การที่ผู้ให้การรักษา ผู้รับการรักษา และผู้วิเคราะห์ข้อมูล ไม่ทราบถึงชนิดการรักษา เรียกว่า Triple blind
3.6 การวิเคราะห์หาความสำคัญทางคลินิกและความสำคัญทางสถิติ
ความสำคัญทางคลินิก หมายถึง ความสำคัญของความแตกต่าง ในอัตราการเกิดผลดี หรือผลเสีย ระหว่างกลุ่มผู้ป่วย ที่ได้รับการรักษาใหม่ และกลุ่มที่ไดรับการรักษามาตรฐาน ของเรามักพิจารณาจาก อัตราการเพิ่มอัตราเสี่ยง (Risk reduction หรือ Risk increase) ในกลุ่มที่ได้รับการรักษาใหม่ เมื่อเทียบกับกลุ่มควบคุม ซึ่งเท่ากับ
| Risk reduction | = | (Rc - Rt) / Rc | |
| Risk increase | = | (Rt - Rc) / Rc | |
| Rc = Risk | ในกลุ่ม control | = | (จำนวนผู้ป่วยในกลุ่ม
control มีผลทางคลินิก) / (จำนวนผู้ป่วยในกลุ่ม control ทั้งหมด) |
| Rt = Risk | ในกลุ่ม treatment | = | (จำนวนผู้ป่วยในกลุ่ม
treatment ที่มีผลทางคลินก) / (จำนวนผู้ป่วยในกลุ่ม treatment ทั้งหมด) |
ตัวอย่างเช่น ความสำคัญทางคลินิกของยา A เมื่อเปรียบเทียบกับ ยา B ต่อตึววัดทางคลินิกต่าง ๆ ที่แสดงในตาราง 12.4 พิจารณาได้ดังนี้
ก. อัตราการเปลี่ยนคลื่นไฟฟ้าสมอง โดยเฉลี่ย Risk reduction = (1 - (- 9)) / 9 = 111%
ข. อัตราการเปลี่ยนแปลงในทางที่ดีขึ้นของการเกิดอัมพาต Risk reduction = (50 - 5) / = 90%
ค. อัตราตายที่เพิ่มขึ้น Risk increase = (50 - 5) / 5 = 900%
โดยหลักทั่วไป แม้ Risk reduction ในการรักษาใด จะไม่มาก แต่ถ้าจำนวนผู้ป่วย ที่เป็นโรคนั้น มีมาก การรักษานั้น ก็อาจจะถือว่า มีความสำคัญทางคลินิก เช่น ยาแอสไพริน ลดอันตรายจาก Myocardial Infarction น้อย แต่จำนวนผู้ป่วยที่เป็น Myocardial infarction มีจำนวนมากในโลก ยาแอสไพริน ย่อมมีความสำคัญทางคลินิก ในการนำมาใช้ร่วมกับ ผู้ป่วยที่มีโอกาสเป็น Myocardial Infardtion
โดยสรุป จึงกล่าวได้ว่า ความสำคัญทางคลินิก บอกเราถึง ขนาดของความต่าง ระหว่างผลการรักษาใหม่ และผลการรักษามาตรฐาน ถ้าขนาดความแตกต่าง ระหว่างการรักษา มีน้อย แต่จำนวนผู้ป่วยที่มีโรคมีมาก การรักษานั้น ก็มีความสำคัญทางคลินิกแน่นอน แม้ว่าจำนวนผู้ป่วยที่เป็นโรค ซึ่งต้องได้รับการรักษานั้น ๆ จะมีจำนวนน้อย
ในทางตรงกันข้าม การพิจารณาความสำคัญทางสถิติ มิได้บอกว่า ขนาดความแตกต่าง ของผลการรักษา มากน้อยเท่าใด แต่บอกว่า ความแตกต่างนั้น มีโอกาสเป็นจริง หรือไม่เป็นจริง มากน้อยเท่าใด ดังที่ได้กล่าวมาแล้ว การสรุปผิดทางสถิติ มีสองชนิด คือ Type I error และ Type II error
Type I error หรือเรียกว่า error เป็นความผิดของการสรุป เมื่อสรุปว่า การรักษาใหม่ กับการรักษามาตรฐาน มีความแตกต่างกัน โอกาสสรุปผิด เรียกว่า P - value ในวารสารส่วนมาก นักจะพิจารณาความสำคัญทางสถิติ ในรูปของ P - value ถ้า P - value น้อย โอกาสสรุปผิดก็น้อย โอกาสสรุปถูกก็มีมาก เช่น ถ้า P-value มีค่า 0.01 โอกาสสรุปผิด เท่ากับ 1% และโอกาสสรุปถูกเท่ากับ 99%
สำหรับ Type II eror เป็นความผิดพลาด เมื่อสรุปว่า ยาใหม่ และยามาตรฐาน ให้ผลการรักษาไม่ต่างกัน Type II error อาจเรียกว่า B error สิ่งที่อาจทำให้เกิด Type II error ได้แก่
ก. ขนาดตัวอย่างมีไม่พอ ถ้าความแตกต่าง ระหว่างการรักษาใหม่ กับการรักษามาตรฐานมีน้อย ต้องใช้ตัวอย่างมาก ถึงแสดงความแตกต่างได้ หากใช้ตัวอย่างน้อย การทดลองของเราก็จะมีความไว (sensitivity) หรือความสามารถ ในการแสดงความแตกต่าง (Power) ไม่พอ ในทางสถิติ เราหาความไว หรือความสามารถ ในการแสดงความแตกต่างได้ ซึ่งมีค่าเท่ากับ 1 - B
ข. ความแตกต่างนั้น อาจพบได้ในผู้ป่วยที่มีลักษณะเฉพาะ บางกลุ่ม (Subgroup) เช่น หากทดลองยาแอสไพริน ในการป้องกันการเกิดอัมพาตชั่วคราว เป็นพัก ๆ และพบว่า ยาไม่มีผลการป้องกันการเกิดอัมพาตชั่วราว ในผู้ป่วยที่นำมาศึกษาทั้งหมด ถ้าเราแยกทดสอบทางสถิติ เฉพาะในผู้ป่วยชาย และผู้ป่วยหญิง ก็จะพบว่า แอสไพริน มีฤทธิ์ในการป้องกัน การเกิดอัมพาตเป็นพัก ๆ ในชาย แต่ไม่มีฤทธิ์ดังกล่าวในหญิง การจะอ้างผลจาก subgroup analysis ไปใช้ตัดสินใจ เลือกให้การรักษา จำเป็นต้องทำด้วยความระวัง เพื่อหลีกเลี่ยงปัญหา ที่อาจจะเกิดจากการได้ค่า P-value ต่ำ โดยบังเอิญ เนื่องจากเราทำการทดสอบหลาย ๆ ครั้ง (multiple test problem)
ค. การวางแผนการทดลองไม่ดีพอ เช่น การเลือก และการตัดผู้ป่วยออก เป็นไปโดยเกณฑ์ที่ไม่แน่นอน หรือมีอคติ การวัดผล ที่ไม่ถูกต้อง เชื่อถือไม่ได้ มีอคติในการให้การรักษาร่วมอย่างอื่น ไม่เท่าเทียมกัน ในผู้ป่วยกลุ่มต่าง ๆ รวมทั้งอคติ ที่เกิดจากการแบ่งกลุ่มด้วย
การพิจารณาความสำคํญทางคลินิก และทางสถิติ จึงต้องกระทำร่วมกัน เนื่องจากว่า ถ้าจำนวนคนไข้มากจริง ๆ อาจจะสรุปทางสถิติได้ว่า การรักษาไม่ต่างกัน โดยที่ผลต่างนั้น ไม่มีความสำคัญทางคลินิก แต่ถ้าจำนวนคนไข้น้อยไป อาจจะสรุปทางสถิติว่า ผลการรักษาไม่ต่างกันทั้ง ๆ ที่ ผลต่างนั้น ถ้าเป็นความจริง จะมีความสำคัญทางคลินิกได้
3.7 ปัญหาทางจริยธรรม
การวิจัยในคน ต้องคำนึงถึงปัญหาทางจริยธรรม ซึ่งจะมีได้สองลักษณะ
3.7.1 สมดุลย์ระหว่างการเสี่ยง กับประโยชน์ที่คาดว่าจะได้รับ ก่อนเริ่มที่ทำการวิจัย จะต้องมีการค้นคว้าวารสารอย่างถี่ถ้วน และต้องสรุปได้ว่า เรื่องที่จะทำวิจัยนั้น ยังไม่ทราบกันชัดเจน คือยังไม่ทราบแน่ว่า ยา การรักษา หรือการป้องกันชนิดใหม่ จะให้ผลดีต่อผู้ป่วย มากกว่าผลเสียหรือไม่ หากยาได้ผลดี และไม่ได้นำมาใช้ เพราะไม่ทราบ ก็จะเป็นการผิดจริยธรรม ในการรักษา ในตรงกันข้าม หากยาไม่ได้ผลดีจริง และเรานำมาใช้ นอกจากจะผิดจริยธรรม เพราะสิ้นค่าใช้จ่ายโดยไม่จำเป็นแล้ว ยังอาจจะมีผลเสียต่อผู้ป่วย เนื่องจากภาวะแทรกซ้อนของยาอีกด้วย
ฉะนั้น หากผลการค้นวารสารพบว่า การรักษาน่าจะได้ผลดี มากกว่าผลเสีย แต่ข้อสรุปยังไม่ชัดเจน ก็จะเริ่มวางแผนการวิจัยได้ โดยไม่ผิดจริยธรรม
3.7.2 การป้องกันผู้ป่วย ผู้ป่วยจะต้องได้รับการอธิบายถึงข้อดี และข้อเสีย ที่ทราบกันในปัจจุบัน เกี่ยวกับการป้องกัน หรือการรักษาใหม่ และการป้องกัน หรือการรักษามาตรฐาน และผู้ป่วยจะต้องมีสิทธิในการเลือก ว่าจะยินยอมเข้าร่วม ในการศึกษาค้นคว้า หรือไม่ ผู้วิจัยจะต้องให้ความมั่นใจว่า หากผู้ป่วยเกิดตัดสินใจที่จะ ถอนตัวออกจากการรักษา ก็จะต้องมีสิทธิของผู้ป่วย ที่จะกระทำได้เสมอ โดยไม่มีผล ต่อการรักษามาตรฐาน ที่ผู้ป่วยได้รับ ในฐานะที่เป็นค�นไข้ธรรมดาคนหนึ่ง รายละเอียดเรื่องนี้ ได้กล่าวไว้ในบทที่เกี่ยวข้องแล้ว